一種新型的紫杉烷生物素共軛物的制備
所屬欄目:藥學論文 發布日期:2019-05-22 10:02 熱度:
摘要:生物素與腫瘤細胞表面的生物素受體結合ꎬ通過受體介導的內吞作用將共軛物攝入細胞內ꎬ二硫鍵在腫瘤細胞中能夠開鏈ꎬ釋放出活性物質ꎬ實現靶向性給藥ꎬ從而大大降低傳統化療藥物因缺乏對腫瘤細胞的選擇性而引起的毒副作用ꎮ 用巰基置換的方式ꎬ合成含有二硫鍵的連接鏈ꎻ用將羧酸基團轉化為酰肼基團的方法ꎬ將生物素轉化為生物素酰肼ꎻ選用具有抗多藥耐藥性的含氟紫杉烷 SB ̄T ̄12854 作為細胞毒分子ꎻ通過含有二硫鍵的連接鏈將含氟紫杉烷化合物 SB ̄T ̄12854 與生物素酰肼進行偶連ꎬ形成一種新型的紫杉烷生物素共軛物ꎮ
關鍵詞:腫瘤靶向型給藥系統ꎻ紫杉烷ꎻ生物素ꎻ共軛物
0 引言
紫杉醇和多西紫杉醇作為第一代紫杉烷類抗腫瘤藥物在臨床治療中被廣泛應用ꎬ主要用于治療乳腺癌、子宮癌、非小細胞型肺癌等ꎮ 第一代紫杉烷類藥物作為傳統的化療藥物ꎬ對于正常組織細胞和腫瘤細胞的選擇性差ꎬ在殺傷腫瘤細胞的同時對正常組織細胞同樣具有毒副作用ꎮ 因此ꎬ多種紫杉醇靶向型腫瘤給藥系統被研發出來ꎮ 例如 Cell Therapeutics 公司研發的聚谷氨酸紫杉醇(paclitaxel poliglumexꎬXyotax)是紫杉醇與生物可降解聚谷氨酸聚合物的結合體ꎮ 這種聚合物技術創造出一種新化學實體ꎬ 能將更多更有效的活性化療藥選擇性地輸送到腫瘤部位ꎮ [1] Protarga 公司研發的 Taxoprexin(DHA ̄paclitaxel)采用紫杉醇和人體必需脂肪二十二碳六烯酸(Docosahexaenoic acidꎬDHA)相結合ꎬ臨床前試驗表明ꎬ腫瘤細胞由于代謝的加快對脂肪酸的攝取量也隨之增加ꎬ因此將化療藥物與脂肪酸結合ꎬ可以增加化療藥物對腫瘤細胞的靶向性ꎬ從而增強治療效果ꎮ [2]腫瘤的快速增殖需要大量的營養物質和維生素ꎬ因此在腫瘤細胞表面過表達與其相應的受體ꎬ能夠轉運營養物質或維生素進入到腫瘤細胞中供給腫瘤生長ꎮ 利用腫瘤細胞表面過表達特殊的抗原ꎬ將與其特異性結合的單克隆抗體與紫杉醇連接ꎬ可以有效地別腫瘤細胞ꎬ從而達到靶向性給藥的目的ꎮ [3 ̄4]
腫瘤靶向型的藥物傳輸系統一般是由腫瘤識別部分和細胞毒分子直接連接ꎬ或者兩部分通過一個鏈相連形成一個共軛化合物ꎬ這個共軛化合物可以看作前藥ꎬ不具有活性ꎬ這也就意味著該共軛物能夠在血液循環中穩定的存在ꎬ當進入到腫瘤組織后能夠高效地釋放出活性細胞毒分子ꎬ從而達到治療的目的ꎮ 基于上述原理ꎬ腫瘤識別部分選用生物素與新型的紫杉烷類衍生物進行偶聯ꎬ生物素能夠與腫瘤表面的受體特異性結合ꎬ通過受體介導的內吞作用進入到腫瘤細胞中ꎬ [5]在腫瘤細胞的環境中水解釋放出活性細胞毒分子ꎮ
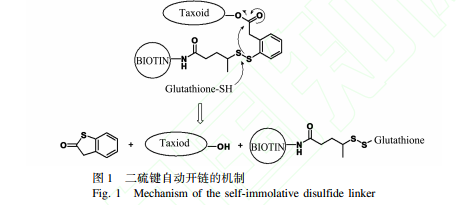
基于谷胱甘肽在腫瘤細胞中的含量高于血液中 1 000 倍以上ꎬ [6] 設計開發了一個含有二硫鍵的簡單側鏈將紫杉烷類化合物與生物素連接起來ꎬ可以確保共軛物在血液循環時穩定ꎬ進入腫瘤細胞后ꎬ二硫鍵在谷胱甘肽的作用下發生開鏈ꎬ釋放出活性細胞毒分子從而會發揮作用(見圖 1)ꎮ [7] 合成的紫杉烷類衍生物ꎬ在體外對于多藥耐藥型的腫瘤細胞株的活性高于第一代紫杉烷類藥物 2 ̄3 個數量級ꎬ [8]其中二氟乙烯基取代 C3'位得到的一系列紫杉烷衍生物活性良好ꎬ [9]選取其中具有代表性的含氟化合物 SB ̄T ̄12854 作為活性細胞毒分子ꎬ與生物素通過已經驗證的二硫鏈相連接ꎬ形成一個新的 SB ̄T ̄12854 ̄生物素共軛物(見圖 2)ꎮ
1 材料與方法
1.1 實驗材料
化合物 SB ̄T ̄12854 由本課題組制備ꎬ結構經過1H ̄NMRꎬMS 確證ꎮ 實驗中相關化學試劑均購于 Aldrich和 Sigma 試劑有限公司ꎮ 甲醇、二氯甲烷等溶劑需要提前做無水處理ꎬ反應監測采用的是 TLC 法ꎬ薄層層析硅膠板的型號為 0.25 mm E. Merck (60 F254 )ꎻ柱層析分離純化使用的是快速制備儀器 Biotage Isolera Iꎬ所用的硅膠為 300 ̄400 meshꎮ 反應收率為過柱純化后計算而得ꎮ1H ̄NMR 和13 C ̄NMR 采用 500MHz 型 BrukerAvanceⅢ核磁共振波譜儀器ꎮ 質譜數據采用離子肼質量分析器 Thermo Electron LCQ Deca XP / Ad。
1. 2 實驗方法
紫杉烷-生物素共軛物的合成ꎬ可以分為三部分ꎬ第一部分合成含有二硫鍵的連接鏈ꎬ第二部分將生物素轉化為生物素酰肼ꎬ第三部分將通過含有二硫鍵的連接鏈將含氟紫杉烷化合物 SB ̄T ̄12 854 與生物素酰肼進行偶連ꎬ形成最終的共軛物ꎮ 二硫鏈部分的設計合成是基于其在腫瘤組織中受到谷胱甘肽的進攻ꎬ二硫鍵會發生開鏈ꎬ游離的巰基會進一步發生親核進攻釋放出活性細胞毒分子ꎬ該部分的合成主要采用巰基置換的方式進行合成ꎮ 生物素部分的改造是將羧酸基團轉化為酰肼基團ꎬ主要是有助于其與二硫鏈的縮合連接ꎮ共軛物的制備首先將紫杉烷 SB ̄T ̄12 854 的 2’羥基與二硫鏈的羧酸基團進行酯化縮合ꎬ再與生物素部分進行偶連ꎬ最終得到目標化合物(見圖 3)。
反應條件:(a)高錳酸鉀ꎬ二氯甲烷ꎬ室溫ꎻ(b)硫脲ꎬ氫溴酸ꎬ70 ℃ꎻ(c)氫氧化鈉溶液ꎬ室溫ꎻ( d)乙醇ꎬ回流ꎻ( e)三異丙基氯硅烷ꎬ三乙胺ꎬ二氯甲烷ꎬ室溫ꎻ(f)30%雙氧水溶液ꎬ乙醇ꎬ室溫ꎻ(g)氫氧化鋰ꎬ水/ 四氫呋喃ꎬ60 ℃ꎻ(h)乙醇ꎬ室溫ꎻ(i)氯化亞砜ꎬ甲醇ꎬ回流ꎻ(j)水合肼ꎬ甲醇ꎬ回流ꎻ(k)NꎬN’ ̄二異丙基碳二亞胺ꎬ4 ̄二甲氨基吡啶ꎬ二氯甲烷ꎬ室溫ꎻ( l)70%氫氟酸吡啶溶液ꎬ乙腈/ 吡啶ꎬ0 ℃ꎻ(m)N ̄羥基琥珀酰亞胺ꎬNꎬN’ ̄二異丙基碳二亞胺ꎬ4 ̄二甲氨基吡啶ꎬ二氯甲烷ꎬ室溫ꎻ( n)二甲基亞砜ꎬ室溫ꎮ
1.2.1 二硫鏈部分
1.2.1.1 化合物 1 的制備
2 ̄巰基吡啶(15 gꎬ135 mmol)溶解在150 mL 的二氯甲烷中ꎬ向反應液中緩慢地加入高錳酸鉀(62 gꎬ405 mmol)ꎬ加料完畢后劇烈攪拌ꎬTLC 監測反應ꎮ 反應結束后ꎬ過濾濃縮反應液ꎬ得到無色針狀晶體化合物 1ꎮ
1.2.1.2 化合物 2 的制備
5 ̄甲基戊內酯(2 0 gꎬ20 mmol)溶解于 15 mL 的氫溴酸中ꎬ在 70 ℃下ꎬ向反應液中緩慢地加入硫脲(8 0 gꎬ100 mmol)ꎬ加料完畢后回流過夜反應ꎮ 反應液冷卻后用 50 mL 冷水稀釋ꎮ 水相分別用乙醚和二氯甲烷洗滌多次ꎮ 然后用 10 mol / L 的氫氧化鈉溶液調節水相的 pH 為 13ꎮ 收集水相ꎬ回流劇烈攪拌 2 hꎮ 反應結束后ꎬ反應液冷卻至室溫ꎬ使用 1 mol / L 鹽酸調節反應液的 pH 為 2ꎮ 水相使用二氯甲烷(3×50 mL)進行萃取ꎬ合并有機相ꎬ先后經水ꎬ飽和食鹽水洗滌ꎬ無水硫酸鎂干燥ꎬ得到無色油狀化合物 2ꎮ
1.2.1.3 化合物 3 的制備
化合物 1(13 7 gꎬ62 6 mmol) 溶解于 250 mL 無水乙醇中ꎬ氮氣保護ꎬ加熱至反應液回流ꎮ 化合物 2 (1 54 gꎬ11 5 mmol)溶解于 100 mL 的無水乙醇中ꎬ向反應液中緩慢的加入ꎮ TLC 監測反應ꎬ待反應結束后ꎬ反應液冷卻至室溫ꎬ蒸干溶劑ꎬ殘留物直接過柱分離純化得到黃色油狀物化合物 3ꎮ
1.2.1.4 化合物 4 的制備
化合物 3(1 59 gꎬ6 53 mmol)溶解于 35 mL 的二氯甲烷中ꎬ向反應液中加入 1 4 mL 的三乙胺ꎬ在 0 ℃下反應ꎬ向反應液中滴加三異丙基氯硅烷(2 5 mLꎬ9 8 mmol)ꎬTLC 檢測反應進行ꎮ 反應結束后ꎬ向反應液中加入 5 mL 的飽和氯化銨溶液停止反應ꎬ加入 100 mL 水稀釋ꎬ接著用二氯甲烷萃取水相ꎬ合并有機相ꎬ飽和食鹽水洗滌ꎬ無水硫酸鎂干燥ꎬ濃縮過柱分離得到無色油狀物化合物 4ꎮ
1.2.1.5 化合物 5 的制備
2 ̄溴酸苯并噻吩(2 gꎬ20 mmol) 溶解于 40 mL 無水乙醇中ꎬ向反應液中滴加 30% 雙氧水( 7 2 mLꎬ40 mmol)ꎮ 反應液在室溫下攪拌反應ꎬTLC 監測反應進行ꎮ 待反應結束后ꎬ先向反應液中加入 50 mL 水稀釋ꎬ然后用二氯甲烷萃取ꎬ合并有機相ꎬ飽和食鹽水洗滌后ꎬ無水硫酸鎂干燥ꎬ過濾濃縮ꎬ過柱分離純化得到淡黃色的油狀化合物 5ꎮ
1.2.1.6 化合物 6 的制備
化合物 5(1 65 gꎬ11 mmol)溶解于 50 mL 四氫呋喃中ꎬ在 60 ℃下ꎬ向反應液中緩慢地滴加氫氧化鋰溶液 (1 58 gꎬ66 mmol)ꎮ TLC 監測反應ꎬ待反應結束后ꎬ先將反應液冷卻至室溫ꎬ用 1 mol / L 鹽酸調節反應液的pH 至 2ꎬ然后用乙酸乙酯多次萃取ꎮ 合并有機相ꎬ飽和食鹽水洗滌后ꎬ經無水硫酸鎂干燥ꎬ過濾濃縮ꎬ過柱分離純化得到淡黃色固體化合物 6ꎮ
1.2.1.7 化合物 7 的制備
化合物 4(1 05 gꎬ2 63 mmol)和化合物 6(0 74 gꎬ4 4 mmol)溶解于 10 mL 的四氫呋喃中ꎬ0 ℃下反應ꎬTLC 監測反應進行ꎮ 待反應結束后ꎬ蒸除多余溶劑直接過柱分離純化ꎬ得到無色油狀物化合物 7ꎮ
1.2.2 生物素部分
1.2.2.1 化合物 8 的制備
生物素(300 mgꎬ1 20 mmol)溶解于 3 mL 甲醇中ꎬ冷卻至 0 ℃ꎬ向反應液中緩慢的加入 0 3 mL 的二氯亞砜ꎬ在室溫下反應過夜ꎮ 反應結束后ꎬ濃縮反應液ꎬ殘余物用正己烷潤洗得到白色固體化合物 8ꎮ
1.2.2.2 化合物 9 的制備
化合物 8(150 mgꎬ0 58 mmol)溶解于 2 mL 的甲醇中ꎬ向反應液中滴加 0 2 mL 的水合肼ꎮ 回流反應 8 h后ꎬ待反應液冷卻至室溫后ꎬ蒸出多余的甲醇ꎬ先后用正己烷和乙醚洗滌殘余物ꎬ得到白色固體化合物 9ꎮ
1.2.3 SB ̄T ̄12854 ̄二硫鏈 ̄生物素偶連
SB ̄T ̄12854 由本課題組以 10 ̄去乙酰基巴卡亭 III 通過半合成的方式制備ꎬ結構經 MS 和1H ̄NMR 確證ꎮ
1.2.3.1 化合物 10 的制備
化合物 7(78 mgꎬ0 17 mmol)溶解于 4 mL 的二氯甲烷中ꎬ先后向反應液中加入 4 ̄二甲氨基吡啶 DMAP (6 mgꎬ0 049 mmol)ꎬ接著加入 Nꎬ N ̄二異丙基碳二亞胺 DIC(0 027 mLꎬ0 17 mmol)ꎬ反應 10 min 后ꎬ向反應液中加入化合物 SB ̄T ̄12854(85 mgꎬ0 098 mmol)ꎬTLC 監測反應進行ꎮ 待反應結束后ꎬ蒸除殘余溶劑ꎬ過柱分離純化得到白色固體化合物 10ꎮ
1.2.3.2 化合物 11 的制備
化合物 10(88 mgꎬ0 067 mmol)溶解于 6 mL 乙腈/ 吡啶( v ∶ v = 1∶1)中ꎬ冷卻至 0 ℃ꎬ向反應液中加入1 mL70%的 HF / Py 溶液ꎮ 在室溫下過夜反應ꎬ反應結束后ꎬ向反應液中加入 20 mL 的碳酸氫鈉溶液中和過量的氫氟酸ꎬ接著多次乙酸乙酯萃取ꎮ 合并有機相ꎬ多次使用飽和硫酸銅溶液洗滌過量的吡啶ꎬ然后經飽和食鹽水洗滌ꎬ無水硫酸鎂干燥ꎬ過濾濃縮ꎬ過柱分離純化ꎬ得到白色固體化合物 11ꎮ
1.2.3.3 化合物 12 的制備
化合物 11(67 mgꎬ0 058 mmol)和 N ̄羥基琥珀酸(14 mgꎬ0 116 mmol)溶解于 4 mL 的二氯甲烷中ꎬ冷卻至 0 ℃ꎬ先后向反應液中加入 DIC(0 012 mLꎬ0 075 mmol)和 DMAP(6 mgꎬ0 049 mmol)ꎮ 反應在室溫下攪拌過夜ꎬ反應結束后ꎬ直接過柱分離純化得到白色固體化合物 12ꎮ
1.2.3.4 化合物 13 的制備
化合物 9(13 mgꎬ0 052 mmol)和化合物 12(53 mgꎬ0 043 mmol)溶解于 1 mL 的 DMSO 中ꎬTLC 監測反應進行ꎬ待反應結束后ꎬ直接過柱分離純化得到白色固體化合物 13ꎮ2 結果與分析化合物 3 和化合物 7 由于結構中有酸性基團和二硫鍵的存在導致化合物不穩定容易分解ꎬ因此需要直接進行下一步反應ꎬ或短期在低溫下保存ꎮ 在整個合成過程中所用的中間體以及最終的目標產物的結構均經過 MS 和 NMR 的確證ꎮSB ̄T ̄12854 為白色固體ꎮ ESI ̄MS m/ z: 864 8 (M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 8 12 (dꎬ J =7 5 Hzꎬ 2H)ꎬ 7 61 (tꎬ J = 7 4 Hzꎬ 1H)ꎬ 7 50 (tꎬ J = 7 7 Hzꎬ 2H)ꎬ 6 36 ̄6 19 (mꎬ 2H)ꎬ 5 66 (dꎬ J = 7 0Hzꎬ 1H)ꎬ 5 06 ̄4 92 (mꎬ 2H)ꎬ 4 88 ( dꎬ J = 8 7 Hzꎬ 1H)ꎬ 4 64 ̄4 51 (mꎬ 1H)ꎬ 4 51 ̄4 40 (mꎬ 1H)ꎬ4 36 ̄4 25 (mꎬ 2H)ꎬ 4 18 (dꎬ J = 8 4 Hzꎬ 1H)ꎬ 3 81 ( dꎬ J = 7 0 Hzꎬ 1H)ꎬ 3 53 ( dꎬ J = 5 4 Hzꎬ 1H)ꎬ3 21 (sꎬ 1H)ꎬ 3 04 ( sꎬ 3H)ꎬ 2 96 ( sꎬ 3H)ꎬ 2 53 ( dddꎬ J = 14 9ꎬ 9 6ꎬ 6 7 Hzꎬ 1H)ꎬ 2 45 ̄2 33 (mꎬ4H)ꎬ 2 33 ̄2 23 (mꎬ 1H)ꎬ 1 97 ̄1 83 (mꎬ 4H)ꎬ 1 67 (sꎬ 3H)ꎬ 1 30 (sꎬ 9H)ꎬ 1 25 (dꎬ J = 1 7 Hzꎬ 3H)ꎬ1 16 (sꎬ 3H).
化合物 1(27 2gꎬ92%)為無色針狀晶體ꎮ ESI ̄MS m/ z: 221 3 (M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 8 45(mꎬ 2H)ꎬ 7 60 (mꎬ 4H)ꎬ 7 10 (mꎬ 2H).
化合物 2(1 9 gꎬ 71%)為無色油狀物ꎮ ESI ̄MS m/ z: 135 1 (M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 11 2 (sꎬ 1H)ꎬ 2 91 (mꎬ 1H)ꎬ 2 49 (mꎬ 2H)ꎬ 1 94 (mꎬ 1H)ꎬ 1 73 (mꎬ 1H)ꎬ 1 47 ( dꎬ J = 6 8 Hzꎬ1H)ꎬ 1 32 (dꎬ 6 8 Hzꎬ 3H).
化合物 3(2 2 gꎬ 77%)為黃色油狀物ꎮ m/ z: 244 3(M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 9 6 (sꎬ1H)ꎬ 8 44 (mꎬ 1H)ꎬ 7 63 (mꎬ 1H)ꎬ 7 22 (mꎬ 1H)ꎬ 7 08 (mꎬ 1H)ꎬ 3 0 (mꎬ 1H)ꎬ 2 5 (tꎬ J = 8 1 Hzꎬ2H)ꎬ 1 97 (mꎬ 1H)ꎬ 1 92 (mꎬ 1H)ꎬ 1 31 (dꎬ J = 6 9 Hzꎬ 3H).
化合物 4(2 4 gꎬ 94%)為無色油狀物ꎮ ESI ̄MS m/ z: 400 8 (M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 8 45 (mꎬ 1H)ꎬ7 63 (mꎬ 1H)ꎬ 7 2 (mꎬ 1H)ꎬ 7 08 (mꎬ 1H)ꎬ 3 04 (mꎬ 1H)ꎬ 2 51 (tꎬ J = 8 1 Hzꎬ 2H)ꎬ1 97 (mꎬ 1H)ꎬ 1 81 (mꎬ 1H)ꎬ 1 31 (dꎬ J = 6 9 Hzꎬ 3H)ꎬ 1 25 (mꎬ 21H).
化合物 5(2 3 gꎬ 77%)為淡黃色固體ꎮ ESI ̄MS m/ z: 151 8 (M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 7 40 ̄7 28 (mꎬ 4H)ꎬ 4 04 (sꎬ 2H).
化合物 6(1 9 gꎬ 84%)為淡黃色固體ꎮ ESI ̄MS m/ z: 169 5 (M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 7 40 (mꎬ 1H)ꎬ 7 26 ̄7 16 (mꎬ 3H)ꎬ 3 82 (sꎬ 2H)ꎬ 3 49 (sꎬ 1H).
化合物 7(0 59gꎬ35%)為無色油狀物ꎮ ESI ̄MS m/ z: 457 6 (M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 7 72 (dꎬ J = 7 8 Hzꎬ 1H)ꎬ 7 25 ̄7 19 (mꎬ 1H)ꎬ 7 13 (dꎬ J = 4 2 Hzꎬ 2H)ꎬ 3 82 (sꎬ 2H)ꎬ 2 83 (ddꎬ J =13 6ꎬ 6 8 Hzꎬ 1H)ꎬ 2 34 (dtꎬ J = 8 2ꎬ 6 5 Hzꎬ 2H)ꎬ 1 93 ̄1 81 (mꎬ 1H)ꎬ 1 74 (tdꎬ J = 14 6ꎬ 6 8 Hzꎬ1H)ꎬ 1 25 ̄1 13 (mꎬ 6H)ꎬ 1 03 ̄0 91 (mꎬ 18H).
化合物 8(287 mgꎬ93%)為白色固體ꎮ ESI ̄MS m/ z: 259 1(M+H) + . 1H NMR (CD3OD) δ 4 48 (mꎬ1H)ꎬ 4 30 (mꎬ 1H)ꎬ 3 65 (sꎬ 3H)ꎬ 3 20 (mꎬ 1H)ꎬ 2 92 (ddꎬ J = 4 8ꎬ 12 6ꎬ 1H)ꎬ 2 70 ( dꎬ J = 12 6Hz)ꎬ 2 34 (tꎬ J = 7 2 Hzꎬ 2H)ꎬ 1 70 ̄1 53 (mꎬ 4H)ꎬ 1 45 (qꎬ J = 7 2 Hzꎬ 2H).
化合物 9(135 mgꎬ90%)為白色固體ꎮ ESI ̄MS m/ z: 259 1 (M+H) + . 1H NMR (CD3OD) δ 4 49 (mꎬ1H)ꎬ 4 32 (mꎬ 1H)ꎬ 3 22 (mꎬ 1H)ꎬ 2 87 (ddꎬ J = 4 5ꎬ 12 6 Hzꎬ 1H)ꎬ 2 67 (dꎬ J = 12 6 Hzꎬ 1H)ꎬ 2 11 (tꎬ J = 7 2 Hzꎬ 2H)ꎬ 1 70 ̄1 38 (mꎬ 4H)ꎬ 1 30 (qꎬ J = 7 2 Hzꎬ 2H).
化合物 10(88 mgꎬ69%)為白色固體ꎮ ESI ̄MS m/ z: 1303 6 (M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 8 14 (dꎬ J = 7 6 Hzꎬ 2H)ꎬ 7 83 ( dꎬ J = 7 8 Hzꎬ 1H)ꎬ 7 62 ( tꎬ J = 7 4 Hzꎬ 1H)ꎬ 7 52 ( tꎬ J = 7 6 Hzꎬ2H)ꎬ 7 36 ̄7 31 (mꎬ 1H)ꎬ 7 32 ̄7 25 (mꎬ 4H)ꎬ 6 33 ̄6 22 (mꎬ 2H)ꎬ 5 68 ( dꎬ J = 7 0 Hzꎬ 1H)ꎬ 5 12 ̄4 92 (mꎬ 4H)ꎬ 4 49 (ddꎬ J = 10 9ꎬ 6 7 Hzꎬ 1H)ꎬ 4 32 (dtꎬ J = 16 7ꎬ 8 5 Hzꎬ 2H)ꎬ 4 19 (dꎬ J = 8 4 Hzꎬ1H)ꎬ 4 13 (ddꎬ J = 16 3ꎬ 7 7 Hzꎬ 1H)ꎬ 4 00 ( ddꎬ J = 16 3ꎬ 8 4 Hzꎬ 1H)ꎬ 3 82 ( dꎬ J = 7 0 Hzꎬ 1H)ꎬ3 25 (sꎬ 1H)ꎬ 3 05 (sꎬ 3H)ꎬ 2 97 (sꎬ 4H)ꎬ 2 60 ̄2 51 (mꎬ 1H)ꎬ 2 44 (dtꎬ J = 6 5ꎬ 4 6 Hzꎬ 2H)ꎬ 2 42 ̄2 32 (mꎬ 4H)ꎬ 2 24 (ddꎬ J = 15 2ꎬ 8 9 Hzꎬ 1H)ꎬ 1 95 (sꎬ 6H)ꎬ 1 68 ( sꎬ 4H)ꎬ 1 32 ( dꎬ J = 3 8 Hzꎬ12H)ꎬ 1 30 ̄1 23 (mꎬ 6H)ꎬ 1 08 (dꎬ J = 7 5 Hzꎬ 19H).
化合物 11(67 mgꎬ87%)為白色固體ꎮ ESI ̄MS m/ z: 1147 3 (M+H) + . 1H NMR (500 MHzꎬ CDCl3 ) δ 8 13 (sꎬ 2H)ꎬ 7 85 (ddꎬ J = 15 0ꎬ 7 5 Hzꎬ 1H)ꎬ 7 63 (tꎬ J = 7 4 Hzꎬ 1H)ꎬ 7 51 (dꎬ J = 17 6 Hzꎬ 2H)ꎬ7 35 (ddꎬ J = 16 2ꎬ 8 0 Hzꎬ 1H)ꎬ 7 25 (dꎬ J = 6 9 Hzꎬ 3H)ꎬ 6 37 ̄6 22 (mꎬ 2H)ꎬ 5 69 (dꎬ J = 6 3 Hzꎬ1H)ꎬ 5 24 (dꎬ J = 26 6 Hzꎬ 1H)ꎬ 5 19 ̄4 97 (mꎬ 3H)ꎬ 4 46 (sꎬ 2H)ꎬ 4 34 ( dꎬ J = 7 3 Hzꎬ 1H)ꎬ 4 18 (dꎬ J = 18 0 Hzꎬ 1H)ꎬ 3 81 (dꎬ J = 7 6 Hzꎬ 1H)ꎬ 3 06 (sꎬ 3H)ꎬ 2 98 (sꎬ 3H)ꎬ 2 52 (sꎬ 3H)ꎬ 1 91 (tꎬJ = 13 4 Hzꎬ 4H)ꎬ 1 70 (sꎬ 4H)ꎬ 1 36 (dꎬ J = 7 2 Hzꎬ 9H)ꎬ 1 31 ̄1 21 (mꎬ 7H)ꎬ 1 18 (sꎬ 3H).
化合物 12(53 mgꎬ74%)為白色固體ꎮ ESI ̄MS m/ z: 1244 3 (M+H) + . 1H NMR (300 MHzꎬ CDCl3 ) δ 8 13 (dꎬ J = 7 4 Hzꎬ 2H)ꎬ 7 82 ( dꎬ J = 7 5 Hzꎬ 1H)ꎬ 7 62 ( tꎬ J = 7 3 Hzꎬ 1H)ꎬ 7 51 ( tꎬ J = 7 6 Hzꎬ2H)ꎬ 7 43 ̄7 28 (mꎬ 3H)ꎬ 6 35 ̄6 17 (mꎬ 2H)ꎬ 5 67 ( dꎬ J = 6 9 Hzꎬ 1H)ꎬ 5 15 ̄4 88 (mꎬ 4H)ꎬ 4 47 ( ddꎬ J = 10 7ꎬ 6 9 Hzꎬ 1H)ꎬ 4 36 (ddꎬ J = 20 3ꎬ 8 6 Hzꎬ 2H)ꎬ 4 24 ̄4 14 (mꎬ 1H)ꎬ 4 11 (dꎬ J = 2 6 Hzꎬ1H)ꎬ 4 00 (dꎬ J = 17 1 Hzꎬ 1H)ꎬ 3 81 ( dꎬ J = 6 7 Hzꎬ 1H)ꎬ 3 04 ( sꎬ 3H)ꎬ 2 96 ( sꎬ 3H)ꎬ 2 85 ( sꎬ4H)ꎬ 2 68 (tꎬ J = 7 4 Hzꎬ 2H)ꎬ 2 61 ̄2 46 (mꎬ 1H)ꎬ 2 44 ̄2 17 (mꎬ 5H)ꎬ 2 12 ̄1 81 (mꎬ 7H)ꎬ 1 67 (sꎬ3H)ꎬ 1 33 (dꎬ J = 7 1 Hzꎬ 10H)ꎬ 1 28 ̄1 19 (mꎬ 5H)ꎬ 1 16 (sꎬ 3H).
化合物 13(46 mgꎬ79%)為白色固體ꎮ1H NMR (500 MHzꎬ CDCl3 ) δ 9 60 (sꎬ 1H)ꎬ 9 06 (dꎬ J = 17 2Hzꎬ 1H)ꎬ 8 10 (dꎬ J = 7 2 Hzꎬ 2H)ꎬ 7 79 (dꎬ J = 7 3 Hzꎬ 1H)ꎬ 7 59 (tꎬ J = 7 4 Hzꎬ 1H)ꎬ 7 48 (tꎬ J =7 2 Hzꎬ 2H)ꎬ 7 31 (ddꎬ J = 12 1ꎬ 4 3 Hzꎬ 1H)ꎬ 7 24 (dꎬ J = 6 9 Hzꎬ 2H)ꎬ 6 88 (sꎬ 1H)ꎬ 6 24 (dꎬ J =10 3 Hzꎬ 2H)ꎬ 6 05 (sꎬ 1H)ꎬ 5 66 (dꎬ J = 6 9 Hzꎬ 1H)ꎬ 5 32 (sꎬ 1H)ꎬ 5 11 ̄4 93 (mꎬ 3H)ꎬ 4 48 ̄4 40 (mꎬ 2H)ꎬ 4 40 ̄4 33 (mꎬ 1H)ꎬ 4 29 (dꎬ J = 8 1 Hzꎬ 2H)ꎬ 4 17 (dꎬ J = 8 4 Hzꎬ 1H)ꎬ 4 10 (ddꎬ J = 16 5ꎬ6 5 Hzꎬ 1H)ꎬ 4 00 (dꎬ J = 16 4 Hzꎬ 1H)ꎬ 3 87 ̄3 76 (mꎬ 2H)ꎬ 3 10 (ddꎬ J = 11 4ꎬ 6 8 Hzꎬ 1H)ꎬ 3 02 (sꎬ 3H)ꎬ 2 97 ̄2 90 (mꎬ 5H)ꎬ 2 90 ̄2 82 (mꎬ 2H)ꎬ 2 71 (dꎬ J = 12 7 Hzꎬ 1H)ꎬ 2 51 (ddꎬ J = 13 8ꎬ 7 6Hzꎬ 1H)ꎬ 2 35 (dꎬ J = 13 7 Hzꎬ 4H)ꎬ 2 24 (dtꎬ J = 24 8ꎬ 7 2 Hzꎬ 5H)ꎬ 1 92 (dꎬ J = 9 4 Hzꎬ 4H)ꎬ 1 90 ̄1 81 (mꎬ 2H)ꎬ 1 77 ̄1 53 (mꎬ 6H)ꎬ 1 41 (sꎬ 3H)ꎬ 1 33 (sꎬ 8H)ꎬ 1 29 ̄1 24 (mꎬ 4H)ꎬ 1 22 (sꎬ 3H)ꎬ1 16 (sꎬ 3H)ꎬ 1 12 ( dꎬ J = 6 5 Hzꎬ 4H). 13C NMR (126 MHzꎬ CDCl3 ) δ 142 6ꎬ 137 5ꎬ 133 5ꎬ 133 1ꎬ132 9ꎬ 130 9ꎬ 130 9ꎬ 130 1ꎬ 129 3ꎬ 128 6ꎬ 128 5ꎬ 127 8ꎬ 84 6ꎬ 81 0ꎬ 80 3ꎬ 79 0ꎬ 77 3ꎬ 76 3. 76 2ꎬ75 1ꎬ 74 4ꎬ 72 3ꎬ 72 1ꎬ 71 9ꎬ 61 8ꎬ 60 2ꎬ 58 3ꎬ 58 3ꎬ 55 6ꎬ 55 5ꎬ 46 1ꎬ 45 8ꎬ 43 2ꎬ 42 0ꎬ 40 4ꎬ38 6ꎬ 36 6ꎬ 36 4ꎬ 36 0ꎬ 35 6ꎬ 35 4ꎬ 33 1ꎬ 31 4ꎬ 31 1ꎬ 29 6ꎬ 28 1ꎬ 28 0ꎬ 26 7ꎬ 25 2ꎬ 23 5ꎬ 22 3ꎬ22 3ꎬ 20 5ꎬ 14 7ꎬ 9 5. 19F NMR (376 MHzꎬ CDCl3 ) δ ̄83 12 ( dꎬ J = 33 9 Hzꎬ 1H)ꎬ ̄84 77 ( dꎬ J = 34 4Hzꎬ 1H). HRMS (ESI) calcd for C65H84F2N6O19S3(M+H) + : 1387 4887 Found: 1387 4847ꎬ (Δ ̄3 6 ppmꎬ ̄4 9 mDa).
3 討論
為了考察設計合成的紫杉烷-生物素共軛物是否能夠靶向性的進入到腫瘤組織中ꎬ并在谷胱甘肽的作用下二硫鏈是否能夠自動開鏈釋放出細胞毒分子ꎬ合成了三個熒光標記的共軛物作為分子探針ꎬ利用流式細胞儀和熒光顯微鏡進行驗證ꎮ 三個熒光標記共軛物分別是生物素-熒光標記物共軛物、香豆素衍生物-二硫鍵-生物素共軛物、熒光標記的紫杉烷分子-二硫鍵-生物素共軛物(見圖 4)ꎮ 生物素-熒光標記物證明該共軛物能夠通過生物素與腫瘤細胞膜上的相應受體結合ꎬ經過內吞作用進入到腫瘤細胞中ꎮ 香豆素衍生物-二硫鍵-生物素共軛物沒有熒光性ꎬ在熒光顯微鏡下無法觀測ꎬ只有該共軛物進入到腫瘤細胞內在谷胱甘肽的作用下ꎬ香豆素衍生物與二硫鍵發生斷裂之后方能顯現熒光性ꎬ實驗觀測到細胞中的熒光物質證明香豆素與二硫鍵能夠順利地在腫瘤細胞內斷裂釋放出顯熒光性的香豆素衍生物ꎮ 熒光標記的紫杉烷分子-二硫鏈-生物素共軛物在前二者的驗證基礎之上進一步證實紫杉烷-生物素共軛物能夠順利地通過受體介導的內吞作用進入到腫瘤細胞中ꎬ并釋放具有熒光標記的紫杉烷分子ꎬ其與微管蛋白結合ꎬ從而發揮抗腫瘤的作用ꎮ [10]
參考文獻:
[1] SABBATINI Pꎬ BROWN J. A phase I/ II study of PG ̄paclitaxel (CT ̄2103) in patients with recurrent ovarianꎬ fallopian tubeꎬor peritoneal cancer[C] / / 38th Annual Meeting of the American Society of Clinical Oncology. Orlandoꎬ Floridaꎬ American So ̄ciety of Clinical Oncologyꎬ 2002.
[2] BRADLEY M Oꎬ WEBB N Lꎬ ANTHONY F Hꎬ et al. Tumor targeting by covalent conjugation of a natural fatty acid to pacli ̄taxel [J]. Clin Cancer Resꎬ 2001ꎬ 7(10): 3229 ̄3238.
[3] GUILLEMARD Vꎬ SARAGOVI H U. Taxane ̄antibody conjugates afford potent cytotoxicityꎬ enhanced solubilityꎬ and tumortarget selectivity[J]. Cancer Resꎬ 2001ꎬ 61(34): 694 ̄699.
[4] JAIME Jꎬ PAGE M. Paclitaxel immunoconjugate for the specific treatment of ovarian cancer in vitro[ J]. Anticancer Resꎬ2001ꎬ 21(2A): 1119 ̄1128
一種新型的紫杉烷生物素共軛物的制備相關論文期刊你還可以了解:《中國腫瘤雜志2019年1月職稱論文目錄查詢》
文章標題:一種新型的紫杉烷生物素共軛物的制備
轉載請注明來自:http://www.optiwork.cn/fblw/yixue/yaoxue/40211.html
相關問題解答
攝影藝術領域AHCI期刊推薦《Phot...關注:105
Nature旗下多學科子刊Nature Com...關注:152
中小學教師值得了解,這些教育學...關注:47
2025年寫管理學論文可以用的19個...關注:192
測繪領域科技核心期刊選擇 輕松拿...關注:64
及時開論文檢索證明很重要關注:52
中國水產科學期刊是核心期刊嗎關注:54
國際出書需要了解的問題解答關注:58
合著出書能否評職稱?關注:48
電信學有哪些可投稿的SCI期刊,值...關注:66
通信工程行業論文選題關注:73
SCIE、ESCI、SSCI和AHCI期刊目錄...關注:120
評職稱發論文好還是出書好關注:68
復印報刊資料重要轉載來源期刊(...關注:51
英文期刊審稿常見的論文狀態及其...關注:69
